研究内容
はじめに
病原体が個体内に侵入すると、これに対する免疫防御反応が発動され、病原体を駆逐しようとします。世界的に流行しているエイズの原因であるヒト免疫不全ウイルス(human immunodeficiency virus: HIV)も例外ではありません。現在までに、ヒト体内におけるHIVの増殖を抑制する方法として、HIV生活環を標的とした薬剤が開発されてきました。抗HIV剤は、ウイルス生活環において、①吸着・侵入、②逆転写、③組込み、④-⑤翻訳・粒子形成の各過程を標的としたものがあります(図1)。そして、これら異なる標的に対する薬剤を組み合わせて併用することで、より効果的なウイルス複製制御が可能となってきました。しかし、薬剤併用化学療法による薬剤耐性株の出現や長期服用による副作用が認められること、更にはこの方法をもってしても、体内からウイルスを完全に排除する事が出来ないのが現状です。感染拡大予防に必須と考えられているエイズワクチン開発研究においては、機能的かつ量的に十分なウイルス特異的細胞傷害性Tリンパ球(HIV-specific CTL)を誘導する方法が期待されているものの、有効なワクチン開発への戦略は未だ確立されていのが現状です。HIV感染症の予防および治療法を開発するにあたり、個体レベルにおける宿主適応免疫系および細胞レベルでのウイルス増殖機構の更なる解明とその制御法の開発が急務となっています。
私たちは、HIV感染制御ヒト宿主因子(群)を同定することにより、新規エイズ治療法に向けての基盤確立に寄与することを目的とした研究を推し進めています。
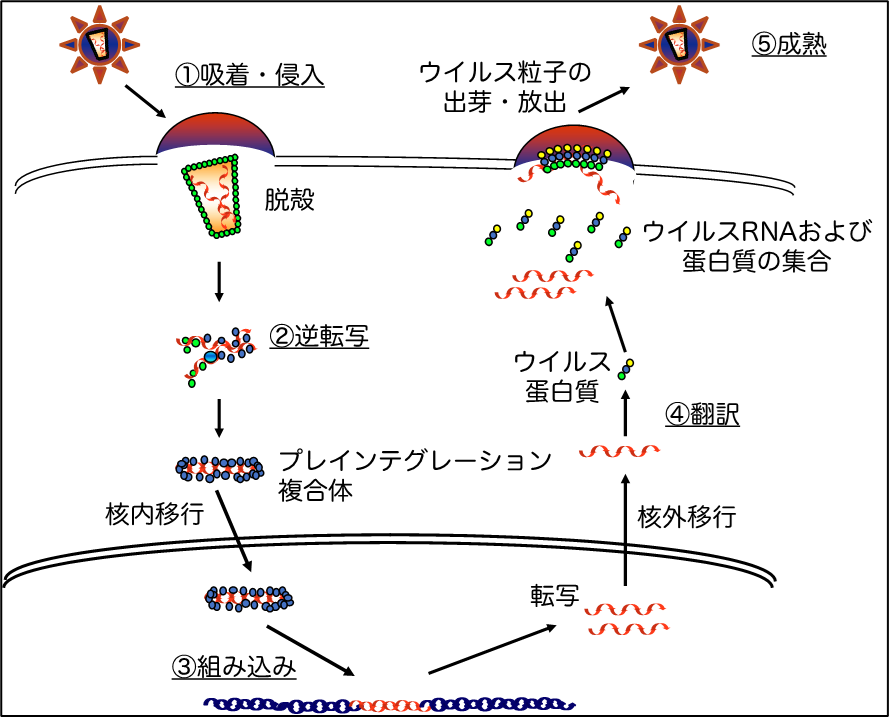
図1 HIVの複製様式
HIVはTリンパ球やマクロファージ等の免疫担当細胞の細胞膜表面上に発現しているCD4分子とケモカイン受容体とを利用して吸着し、標的細胞内に侵入します。侵入後は、逆転写反応によってウイルスRNAからDNAが合成され、細胞核内に移行した後、標的細胞の染色体DNAに組み込まれます。組み込まれたプロウイルスDNAは、細胞由来の転写複製機構を利用してウイルスRNAの転写およびウイルスタンパク質を合成し、細胞膜表面上にてウイルス粒子を構築した後に、子孫ウイルスとして細胞外へ放出されます。
1)ゲノムワイドshRNAスクリーニング法によるHIV-1感染制御因子(群)の網羅的探索
現在までにヒトゲノム情報に立脚したHIV-1感染制御宿主因子探索法として、small interfering RNA (siRNA)によるRNA干渉法を用いたgenome-wide screening法による研究成果が幾つか報告されているが、HIV-1感染標的細胞であるTリンパ球およびマクロファージ等を用いたものではなく、そのため自然感染におけるHIV-1感染伝播での役割については不明な点が多いのが現状です。私たちは、HIV-1感染標的細胞であるTリンパ球を用いて機能遺伝子発現抑制Tリンパ球ライブラリーを構築し、HIV-1感染制御因子群を同定することを試みています。
siRNAを用いた機能遺伝子発現抑制Tリンパ球ライブラリーを構築する際には、幾つか問題点があります。一つ目は、「Tリンパ球へのsiRNA遺伝子導入効率が非常に低いこと」が挙げられ、HIV-1感染標的細胞を用いたgenome-wide screeningを困難なものとしています。二つ目は、「1細胞あたりのsiRNA導入量(種類)を制御出来ないこと」が挙げられます。このことは、目的の表現型を持つ細胞(群)が単離されても、その細胞内に多種のsiRNAが存在していることで、その表現型を反映する機能遺伝子に辿り着くまでに時間と労力を要することを示唆しています。そこで、これらの問題点を克服する為には、「Tリンパ球への遺伝子導入効率を上げること」、「導入される遺伝子量(種類)を制御すること」の条件が必要になると考えられます。
現段階でこれらの条件を満たすことが出来る材料および方法の一つとして、レンチウイルスベクターを用いた遺伝子導入法が挙げられます。レンチウイルスベクターは、Tリンパ球を含む浮遊細胞や非分裂細胞等に遺伝子導入が可能であり、ゲノムDNAへの目的遺伝子の組み込みステップでは、遺伝子組み込み量がある程度制限されるというレンチウイルスの特徴が生かされています*。そこで、レンチウイルスベクターによるgenome-wide shRNA screeningが可能なMISSION LentiPlex Human short hairpin RNA (shRNA) Libraries(Sigma-Aldrich)を用いて、機能遺伝子発現抑制T細胞ライブラリーを構築し、HIV感染制御因子探索を行っています(図2)。
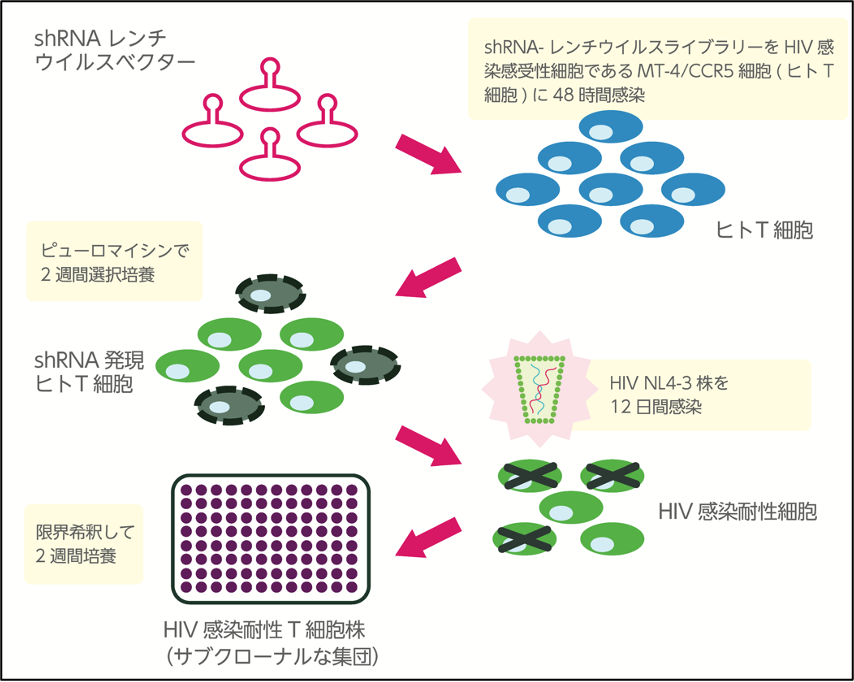
図2 ヒトT細胞株ライブラリーの樹立およびHIV感染耐性細胞株の選択法
ヒト機能遺伝子(約1万8千遺伝子)を標的としたshRNAライブラリーによる機能遺伝子発現抑制T細胞株を作製するため、HIV感染感受性T細胞であるMT4C5細胞をライブラリー作製細胞として選択した。様々な感染条件を検討した結果、1 x 10^5個のMT4C5細胞にMOI=10に相当するshRNA-レンチウイルスライブラリーを48時間感染させた。shRNA発現カセットには、ピューロマイシン耐性遺伝子が含まれていることを利用して、shRNA発現カセットが組み込まれた細胞を選択する目的で、感染48時間後にピューロマイシン(1 µg/ml)を含む培地と交換し、更に2週間選択培養を行った後に、T細胞株ライブラリーを樹立した。その後、樹立したT細胞株ライブラリーを用いて、HIV NL4-3株(MOI = 0.001)を感染させた。感染12日後にHIV感染耐性細胞を限界希釈し、更に2週間培養することで、HIV感染耐性T細胞株を得た。
上記の方法によりHIV-1感染制御宿主因子群の一つとして見出されてきた宿主リン酸化酵素:Maternal Embryonic Leucine Zipper Kinase(MELK)が、長らく謎であったHIV-1コア構造体崩壊の制御を、コア構造体の段階的リン酸化を通じて担っていることをつきとめました(図3)(PLoS Pathog, 2017)。本研究成果は、変異しやすいウイルス由来酵素タンパク質ではなく宿主側感染制御因子を標的とした新規エイズ治療法開発への応用が期待できます。さらには、宿主タンパク質:eukaryotic translation initiation factor 4A isoform 2 (eIF4A2)が、逆転写反応過程を制御する新たな宿主因子として機能していることをつきとめました(Microbes infect, 2018)。
このように、「HIV-1と宿主とのせめぎあい」を次々と明らかにしていくことは、HIV-1感染動態の理解の深化に貢献するだけでなく、新たなHIV-1治癒に向けた基盤確立に貢献するものと考えます。
MELK研究成果インタビュー記事
https://m-hub.jp/biology/1859/103-1
http://www.tmd.ac.jp/cmn/soumu/kouhou/bloom!/vol.24/research_worker27.pdf
http://www.tmd.ac.jp/english/artis-cms/cms-files/Press_10.pdf
https://www.nikkei.com/article/DGXMZO36797000T21C18A0000000
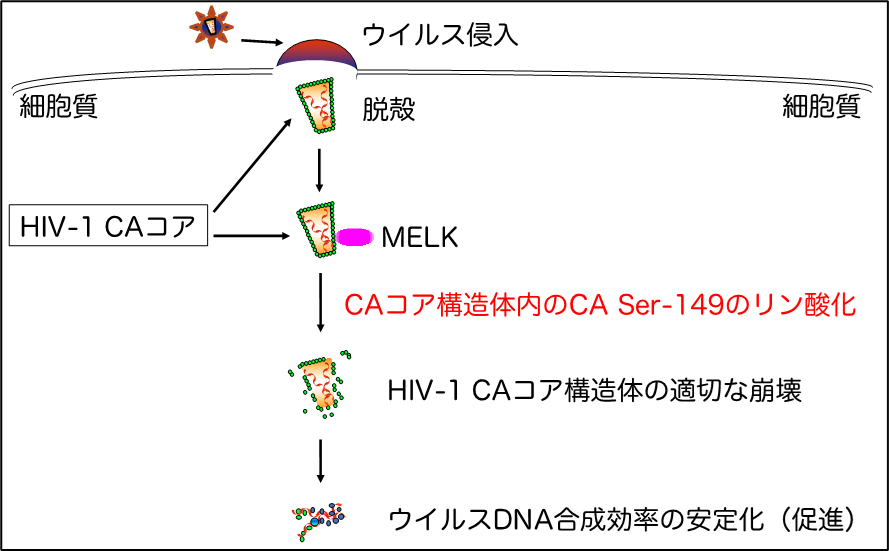
図3 MELKはHIV-1 CAコアのSer-149残基を段階的にリン酸化することでCAコア構造体の崩壊を適切に引き起こす宿主因子である
- HIV-1は、CD4陽性Tリンパ球やマクロファージに感染し、感染細胞内にタンパク質でできた殻(コア構造体)を放出します(脱殻)。
- コア構造体内にはウイルス遺伝子であるRNAや逆転写酵素等が内包されており、ウイルスDNA合成の場を提供します。
- ウイルスDNA合成ステップには、コア構造体が「適切なタイミング」で崩壊する必要があります。
- MELKはコア構造体を形成するHIV-1キャプシドタンパク質(HIV-1 CA)の特定アミノ酸残基(149番目のセリン残基:CA Ser-149)を段階的にリン酸化することによりHIV-1コア構造体崩壊制御を行っていることを明らかにしました。
2)ゲノムワイドshRNAスクリーニング法によるHIV-1潜伏感染制御因子(群)の網羅的探索
HIV感染症の治癒(HIV cure)に向けた最大の問題点は、現状の抗HIV剤併用療法(combination antiretroviral therapy: cART)では排除できないHIVが生体内に存在していることです。このHIVは、①抗HIV剤が生体内において行き届かない場所に存在するHIV、②抗HIV剤が効かなくなった薬剤耐性HIV、もしくは③感染細胞内のプロウイルスからの転写活性レベルが低い状態、すなわち潜伏感染状態のHIV(HIVリザーバ)のいずれかの特徴を有しています。HIVリザーバは、T細胞および単球もしくはマクロファージといったHIV感染標的細胞がリザーバ細胞へと変遷を遂げたものであり、T細胞リザーバではウイルスの活性化と潜伏化がダイナミックに変化していると考えられるのに対し、単球およびマクロファージ細胞リザーバではウイルスが長期的かつ安定的に潜伏化し、感染個体におけるウイルスリザーバ維持に貢献していると考えられます。
現時点において、リザーバ細胞からウイルスをたたき出すことでウイルス感染細胞を体内から排除する、”Kick and Kill”または”Shock and Kill”といった治療法の開発が試みられています。しかしながら、現行のcARTを超える治療効果が得られていないのが現状です。その理由として、(1)プロウイルス再活性化誘導剤(Latency-Reversing Agent: LRA)として用いられているものが、広範な遺伝子発現上昇効果を示すもの(Broad activator)であり、プロウイルス特異的な再活性化効果を示すものではないこと、(2)Broad activatorの効果を持ってしてもプロウイルス再活性化に至らないリザーバ細胞集団が存在すること、などが挙げられます。これらのことは、HIV潜伏感染維持およびプロウイルス再活性化メカニズムの更なる理解が必要であることを示唆しており、その理解が「プロウイルス特異的再活性化誘導剤の開発および効果的なHIV治癒法の基盤確立」に繋がるものと考えられます。
私たちは、潜伏感染状態を安定的に維持することが可能な単球系細胞を用いてHIV-1潜伏感染モデル細胞株(THP-1 Nluc細胞)を樹立し、新たな再活性化誘導剤(LRA)探索に用いるとともに、この細胞を利用した機能遺伝子発現抑制THP-1 Nluc細胞ライブラリーを作製して潜伏感染維持メカニズムに寄与する宿主側要因の探索および同定を進めています。
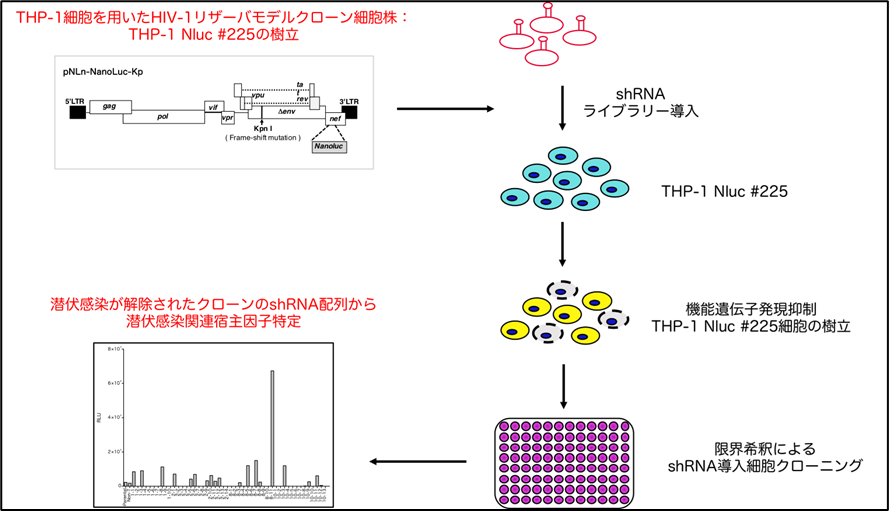
図4 ヒト単球系HIV-1潜伏感染モデル細胞株ライブラリーの樹立およびプロウイルス再活性化クローン細胞株の選択法
単球系HIV-1潜伏感染モデル細胞株(THP-1 Nluc #225)細胞を用いて、ヒト機能遺伝子(約1万8千遺伝子)を標的としたshRNAライブラリーによる機能遺伝子発現抑制THP-1 Nluc #225細胞株ライブラリーを作製した。その後、細胞株ライブラリーを限界希釈し、多数のプロウイルス再活性化クローン細胞を得た。
HIV-1感染増殖伝播過程におけるHuman Mannose Receptor 1 (hMRC1)の役割
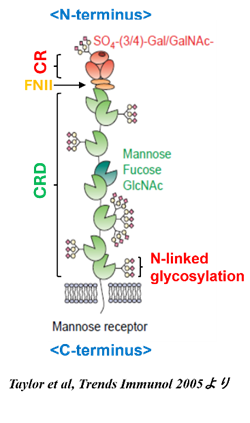
図1.Mannose Receptor 1の構造
(MR,CD206,MRC1)
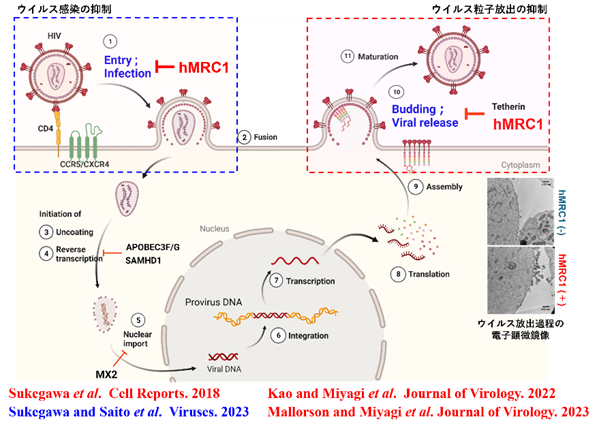
図2.hMRC1によるHIV-1複製抑制機能
Human mannose receptor 1 (hMRC1) は、主にマクロファージや樹状細胞などに発現し(図1)、様々な病原体を、 その糖タンパク質を介して認識することが報告されており、HIV-1も例外ではない。我々は、hMRC1に よるHIV-1感染伝播における役割についてさまざまな知見を報告してきた(図2)。具体的には、①ウイルス粒子の放出抑制機能を有する宿主因子の1つとして既に報告されているBST-2非依存的な機序により、 hMRC1がHIV-1感染単球由来マクロファージにおいHIV-粒子放出を阻害していることを報告した (Sukegawa et al., Cell Report. 2018)。②hMRC1の転写過程における発現調節に関わる宿主因子として、骨髄系細胞特異的に発現している転写因子PU.1を見出した (Kao and Miyagi et al., Journal of Virology. 2022)。③PU.1は、hMRC1のプロモーター領域に存在するPU.1結合領域に作用することで、hMRC1のプロモーター活性上昇に寄与しおり、HIV-1のTatによりその結合が競合阻害されることで、hMRC1の発現量が低下することを報告した (Mallorson and Miyagi et al., Journal of Virology. 2023)。更には、④ hMRC1は、HIV-1放出過程において多様なHIV-1の粒子放出を抑制していた一方で、hMRC1が内包されたHIV-1が新たに感染する段階でウイルス株特異的に制御する機能を報告した (Sukegawa and Saito et al., Viruses. 2023) 。このことから、hMRC1は、ウイルス放出およびウイルス感染前期過程の異なるHIV-1生活環においてHIV-1感染伝播機構を制御していることが考えられる。しかしながら、hMRC1による詳細なHIV-1感染増殖伝播制御メカニズムは未だ不明である。
そこで、我々は、主に、hMRC1による多様なHIV-1 のウイルス放出抑制機能(図2, 赤枠)、およびウイルス 株特異的な感染制御機構(図2, 青枠)に着目し、HIV-1増殖伝播機構の理解の深化に努めると共に、普遍的なHIV-1感染制御法の基盤確立に寄与することを目的とする。本研究は、米国国立衛生研究所(NIH)のKlaus strebel博士との共同研究であり、密に連携を取りながら進める。
HIV-1潜伏感染細胞を再活性化する新規作用機序を有する低分子化合物の探索および合成展開
抗レトロウイルス療法 (ART) の飛躍的な進歩により、HIV感染症は治療可能な慢性疾患としてとらえられつつある。しかしながら、
1) 現行のARTの薬効が十分に作用しない潜伏感染細胞の存在により、ウイルスを体内から完全に駆逐することは極めて困難であること(図3)
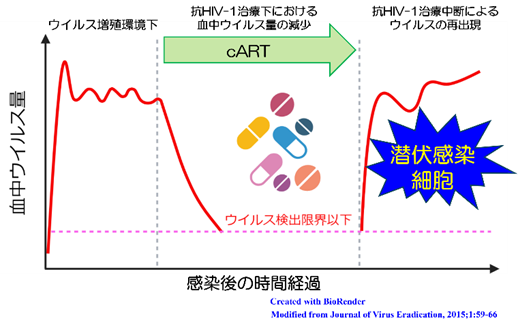
図3.抗HIV-1治療下における血中ウイルス量の推移
2) 既存の抗HIV-1薬に耐性を示す変異ウイルスが蓄積されやすいこと等から、未だ治癒には至っていない。
一方で、HIV-1感染症治癒をめざし、ART併用下において、潜伏ウイルス再活性化誘導剤 (LRA) により、プロウイルスの転写効率を高め (Shock)、ウイルス再活性化細胞の細胞死を誘導する (Kill)、「Shock and Kill」アプローチが試みられている(図4)。
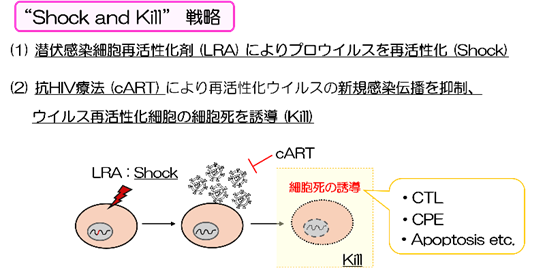
図4.HIV-1感染症治癒に向けた新たなコンセプト
しかし、近年、cARTによりウイルス増殖が抑制されている患者体内において、マクロファージ細胞が主たる潜伏感染細胞であることが報告された (Ganor et al. Nature Microbiol. 2019)。また、単球やマクロファージ細胞は活性化T細胞と比較して、HIV-1が長期間安定的に潜伏感染状態を維持することから、これらの細胞が潜伏感染細胞形成の場として重要な役割を担っている可能性が高いと考えられる。そこで、HIV-1感染症治癒に向けて、T細胞に加えて単球系の潜伏感染細胞においても、効果的かつ特異的にHIV-1プロウイルスの再活性化を誘導する革新的なエイズ治療戦略の基盤確立が急務の課題となっている。
当研究室では、①研究室独自に樹立した単球系HIV-1潜伏感染モデル細胞株【THP-1 NLuc細胞】(Gohda et al. Sci Rep. 2018、Iwase et al. Sci Rep. 2019)、②T細胞系潜伏感染モデル細胞株【J-Lat FL10.6 細胞】において、LRA活性を有する化合物を本学所有の低分子化合物ライブラリーから複数同定してきた(図5)。
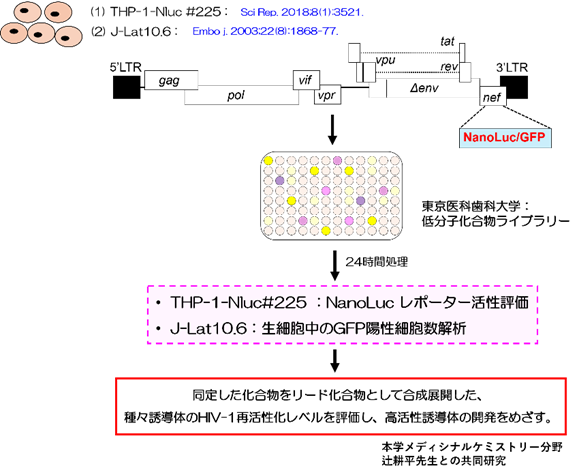
図5.潜伏感染モデル細胞株を用いた低分子化合物ライブラリーによる新規LRA候補化合物の探索法
本研究では、同定した化合物をリード化合物として創薬展開すると共に、その作用機序の解明をおこなうとことで、患者体内の潜伏感染細胞数の減少・排除につながる革新的なHIV治癒法開発へ貢献することを目的としている。
研究内容(SARS-CoV-2)
本分野は東京医科歯科大学SARS-CoV-2全ゲノム解析プロジェクトチームの一員として、東京医科歯科大学病院に入院または通院歴のあるCOVID-19患者のSARS-CoV-2ウイルスの全ゲノム解析を行なっています。これまでに700症例に迫るゲノム解析を行い、解析結果をGISAIDデータベースに登録することで東京都のCOVID-19病態解明および公衆衛生上の意思決定へ貢献してきました。引き続き本学のゲノム解析を進めるとともに、臨床分野との緊密な連携のもと、SARS-CoV-2の性状解明を目指してウイルスのゲノム情報と臨床情報を活用した基礎研究に取り組んでいます。
東京医科歯科大学SARS-CoV-2全ゲノム解析プロジェクトのプレスリリース
https://www.tmd.ac.jp/press-release/20220530-1
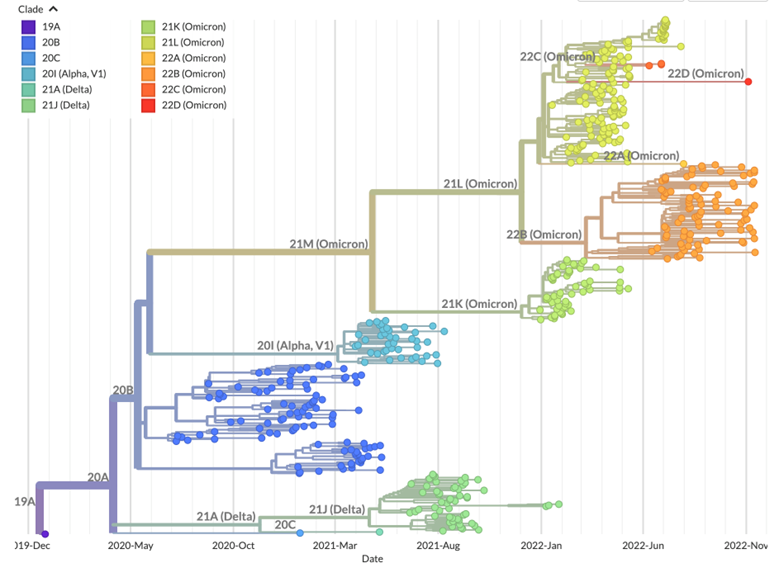
東京医科歯科大学病院患者のSARS-CoV-2ゲノムのNextstrain解析
